- Contribue à la relaxation et réduit l'inconfort articulaire et tendineux
- Substitut vegan aux peptides de collagène marin
- Glycine cristallisée 100% pure et sans additif
- Format poudre facile à doser et goût agréable naturellement sucré
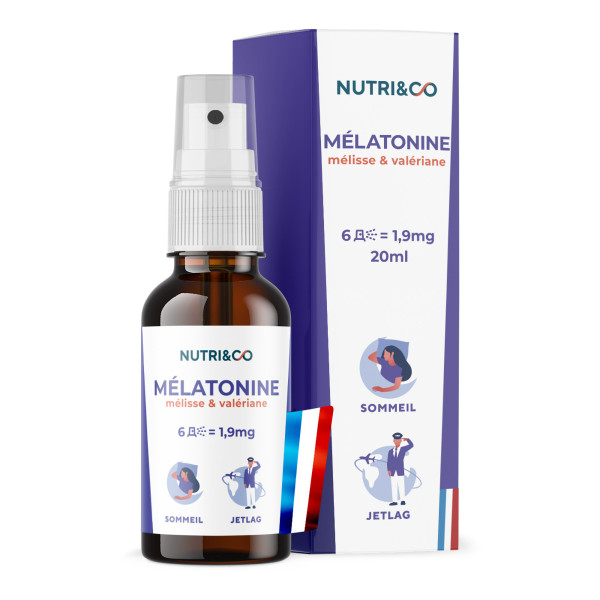
Glycine cristallisée en poudre
Efficacité de la Glycine cristallisée
- 100% pure et sans additif
- 100% vegan certifié
- 1/3des acides aminés du collagène sont constitués de glycine
- 78%des consommateurs de Glycine Nutri&Co sont satisfaits


Les routines associées de la Glycine cristallisée
Découvrez nos produits aux bienfaits complémentaires.
Pourquoi prendre la Glycine cristallisée Nutri&Co ?
La glycine est l’acide aminé protéinogène le plus simple, et dont le nom vient du grec glykys, qui signifie doux, faisant référence à son goût légèrement sucré. Elle est utilisée dans la production de nombreuses molécules, du collagène au glutathion en passant par la créatine.
La glycine, un acide aminé peu présent dans l’alimentation
La glycine est considérée comme un acide aminé protéinogène conditionnellement essentiel, car elle peut être synthétisée par notre organisme mais pas en quantité suffisante pour couvrir tous nos besoins dans la plupart des cas. Les besoins moyens d’un adulte sont de 15 g par jour de glycine pour synthétiser toutes les molécules qui en dépendent mais notre synthèse endogène est limitée à 2,5 g par jour. Malheureusement, les aliments les plus riches en glycine, viandes et poissons, n’apportent qu’1 à 2 g de glycine pour 100 g, loin des 12,5 g manquants.
Le principal constituant du collagène
La glycine est le principal acide aminé constituant du collagène, dont il représente 1/3 des acides aminés dans les tripeptides qui le composent (glycine-proline-Y et glycine-X-hydroxyproline, X et Y étant un autre acide aminé). Un déficit en glycine peut compromettre la stabilité du collagène et limiter son bon renouvellement.
Les Bienfaits d’une cure de Glycine cristallisée
- La L-glycine participe à la synthèse du collagène, dont elle représente environ 30% des acides aminés.
- La L-glycine est un précurseur pour d’autres molécules comme des protéines, la créatine, le glutathion ou l’hème (transport du fer).
- La L-glycine peut aussi agir comme un neurotransmetteur, notamment sur les récepteurs NMDA qui pourraient avoir un lien avec la relaxation et le sommeil.
La meilleure qualité dans un format pratique
Notre Glycine cristallisée est de la plus haute qualité disponible, avec le plus haut niveau de pureté, sans aucun additif. Notre formule se mélange parfaitement dans l’eau, avec un goût naturellement légèrement sucré.
Valeurs nutritionnelles (g) Pour une cuillère doseuse Glycine 5 g Un neurotransmetteur utile pour le sommeil
La glycine agit aussi comme un neurotransmetteur, avec des récepteurs qui lui sont spécifiques dans le système nerveux, en particulier sur les récepteurs NMDA, impliqués dans la neuroplasticité. Ces derniers peuvent aussi influer sur la température corporelle, ce qui permettrait à la glycine d’avoir un effet sur l’endormissement et la qualité de sommeil.
Un précurseur du glutathion
Le glutathion est un antioxydant majeur de l’organisme, synthétisé à partir des acides aminés glutamate, cystéine et glycine. Un déficit en glycine pourrait donc être un facteur limitant dans sa synthèse.
Bienfaits de notre Glycine Cristallisée
Ingrédients et analyses
- Glycine cristallisée 100% pure
Liste des ingrédients
Analyses

Conseils d’utilisation
Notre formule Glycine doit être prise à raison de 1 cuillère doseuse, soit 30 minutes avant le coucher pour son action spécifique sur le sommeil, soit pendant la journée pour ses effets plus généraux.
Combien de dosettes ?
- Enfants : déconseillé.
- Adolescent(e)s : 1/2 cuillère doseuse par jour.
- Adultes : 1 cuillère doseuse par jour.
- Femmes enceintes et allaitantes : 1 cuillère doseuse par jour.
Durée d’une prise
Comment prendre notre formule Glycine
Durée d’un flacon
Précautions d’emploi
Conditions de conservation
Tout savoir sur la Glycine
Références scientifiques

Une infographie ludique pour enfin tout comprendre sur la Glycine
Voir l'infographie
Combien de dosettes pour moi ?
Découvrez en quelques minutes votre posologie personnalisée.
Faire le questionnaire

Vos questions sur la Glycine
Nos experts répondent à toutes vos questions.
Glycine ou collagène ? Quel complément est le plus efficace ?
Est-ce que je peux prendre votre Glycine et votre Collagène en même temps ?
Quels sont les bienfaits de la Glycine pure ?
Existe-t-il un danger ou des effets indésirables à prendre de la glycine ?
Est-ce bon de prendre de la glycine tous les jours ?
La glycine est-elle utile pour la longévité ?
Avec quoi puis-je mélanger votre Glycine ?
Quelle est la dose idéale de glycine à consommer ?
Pharmacie, site... Où acheter notre complément alimentaire de Glycine en poudre ?
Retrouvez nos dossiers et articles relatifs à la Glycine
Paiement
sécuriséLivraison offerte
dès 69€ d'achatLivraison
en 48hParrainer
un procheRécompenses
fidélité